信号交换在大豆有节的早期事件
g . Stacey j . Loh张,中州。李,c . Bickley d .营地g .廖g .科普利
M.G.史黛丝
豆科植物研究中心,诺克斯维尔的田纳西大学微生物系TN, 37996 - 0845,美国
1。监管Bradyrhizobium日本血吸虫的有节的基因
点头的调节基因表达在几个(中国)根瘤菌!Bradyrhizobium !Azorhizobium物种已被广泛研究。现有的证据表明,大多数点头基因参与的生产代替lipo-chitin点头信号诱导根头发卷曲,皮质细胞分裂。调节这些基因的通用模型预测,诺德基因产物由表达和观察与共生产出黄酮类化学物质(如异黄酮)导致诱导其他有节的基因。这个系统点头基因的转录控制是至关重要的感染过程的起始和决定宿主特异性。
继续在我们的实验室研究表明,点头基因调控的通用模型中定义的(中国的)根瘤菌物种的控制不充分考虑点头在b .日本血吸虫基因转录。的确,点头b .日本血吸虫基因调控显示惊人的复杂性(图1)。我们的数据显示,日本血吸虫成员使用三种不同的全球监管控制点头基因表达的蛋白质家族。具体来说,LysR-type监管机构,
-
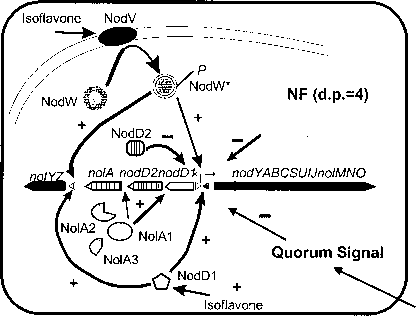
- 图1所示。点头在Bradyrhizobium日本血吸虫基因表达调节复杂的涉及多个正(+)、负(-)监管机构。这种复杂性,我们现在可以通过四聚物的添加负反馈调节点头信号(NF)和一种新的群体信号。这些通过NolAl和NodD2行动。
NodDl和双组分的监管体系,NodVW,积极调节nodYABC基因表达在植物生产异黄酮信号(Loh et al . 1997、1999、2001;Loh,斯泰西2001)。此外,诺拉,MerR-type监管家族成员(见下文),行为间接地抑制点头基因表达(Dockendorff et al . 1994;加西亚et al . 1996年)。不,我一个基因是一种罕见的案例在单个基因编码三种细菌中,不同的多肽(Loh et al . 1999年)。NolAl最大的蛋白质,是一种转录调控蛋白诱导nolA2所需,3以及nodD2。最小的诺拉蛋白质,NolA3,似乎有一个重要的,尽管未定义的函数,有节。NodD2是点头的抑制因子基因的表达。因此,诺拉1的表达最终导致基因表达下调的点头。
最近的数据从我们的实验室,下面描述,表明诺拉是一个中央管理组件,允许细胞应对多种信号分子和精细调节基因表达点头。图1显示了我们的当前工作模式的监管点头的日本血吸虫基因。这个复杂的监管电路的净效应是为生物体提供响应点头基因表达好监管机制,这种监管融入整个细胞的新陈代谢。
b .日本血吸虫基因具有两个诺德安排衔接着nodDxnodDj。NodD2点头基因表达的抑制因子b日本血吸虫(加西亚et al . 1996), Bradyrhizobium sp。(落花生)NC92(吉列和埃尔坎1996)和Sinorhizobium sp.应变NGR234 (Fellay et al . 1998年)。NolAl以来积极激活NodD2表达式,诺拉的表现及调控基因有效地控制了镇压的点头。因此,诺拉是一个中央,有节的负面调节器。
实验过程中旨在衡量nod-lacZ表达式,我们观察到nodY-lacZ融合始终显示更高的活动在化验NodC突变。NodC是几丁质合酶参与合成甲壳素的主干lipo-chitin点头信号。这些数据,连同其他的观察,让我们假定点头信号可以通过NolA-NodD2镇压反馈调节点头信号合成途径。的第一个测试这一假说,我们测试了多种几丁质寡聚物(d.p.-l-8)诱导nolA-lacZ和nodD2-lacZ表达的能力。获得的数据表明几丁质寡聚物做诱导诺拉表达式,甲壳素四聚物是最活跃的(Loh和斯泰西2001)。甲壳素四聚物是活跃诺拉诱导物浓度低至1海里,与最优活动在10纳米。进一步的实验表明,甲壳素是NolAl表达特定的影响(数据没有显示)。
确定不同的根瘤菌产生NodC蛋白质链的长度的信号。例如,从美国NodC meliloti综合主要是甲壳素四聚物。相比之下,从美国NodC sp.应变NGR234主要生产甲壳素五聚物,而b .日本血吸虫生产甲壳素四聚物和五聚物。作为一种手段,提高细胞产生的几丁质水平,我们表示s meliloti sp。NGR234,和b . b .日本血吸虫基因nodC日本血吸虫本构trp启动子的控制下。Transconjugants表达美国meliloti或b .日本血吸虫NodC显示4 - 5折nodC-lacZ表达水平低于应变转换与向量。相比之下,美国的表达sp。NGR234 NodC蛋白质并不影响nodC-lacZ感应高金雀花碱(数据未显示)。这些数据都与以前的结果一致表明,甲壳素四聚物是诺拉的最活跃的诱导物。事实上,组成型表达的美国meliloti NodC没有影响NodC表达当化验诺拉突变背景(数据未显示)。除了点头信号(一个acylated fucosylated五聚物)浓度高达1 | iM野生型的文化没有诱导诺拉表达式。然而,添加合成四聚物的LCOs(请提供的t . Ogawa、理化学研究所、日本)激活诺拉表达和压抑nodC-lacZ表达式。 This result was found regardless of chemical substitutions of the chitin backbone.
以上实验表明诺拉点头基因表达的调节反馈抑制反应细胞内甲壳素四聚物的水平。虽然主要点头信号由b .日本血吸虫是取代,甲壳素五聚物,我们之前的工作记录的生产四聚物的点头信号通过这种细菌(科恩et al . 1999年)。
我们点头基因调控研究的一个令人费解的方面是要求被诱导细胞(与染料木黄酮或年代SE)在低细胞密度为了看到最大nod-lacZ表达式。这一现象表明,点头可以调控基因表达在一个人口密度制约的方式,被压抑的高细胞密度。诺拉的负调节系统的发现和NodD2促使我们更密切地关注这个问题。概略地在图1所示,可诱导性(fold-induction) nodY-lacZ聚变反应下降的生产群体b .日本血吸虫细胞释放的信号(Loh et al . 2001年)。人口密度并不影响nodY-lacZ表达式在诺拉突变背景。因此,诺拉似乎直接参与镇压点头在人口密度高的基因表达。实际上,其他试验用菌株nolA-lacZ或nodD2-lacZ融合显示,这些蛋白质的水平增加而增加细胞密度(数据未显示)
过滤、文化上层清液含有一种我们称为nolA-lacZ CDF实验组的诱导物,细胞密度因子(Loh et al . 2001年)。在大多数这样的革兰氏阴性细菌群体感应高丝氨酸内酯化合物是修改。然而,重复尝试使用各种方法未能隔离高丝氨酸内酯b从日本血吸虫的文化。我们已经成功地净化少量提供,这表现出诱导nolA-lacZ融合的能力。纯化CDF,正如预期的那样,也有抑制点头基因表达的能力。这种化合物的化学特性是目前正在接受调查。
存在一个巨大的商业行业生产b .日本血吸虫菌剂对农业使用。公司生产这些各种常规增长他们的文化高细胞密度最终包装细胞,加上载体(如泥炭)。这种商业一样一个常见的问题是他们竞争对土著结节入住率非常糟糕,土壤日本血吸虫菌株。这是被称为“竞争问题”。事实上,在某些情况下,b .日本血吸虫应变在商业变质剂可能只占0到1 - 2%的结节形成。
发现它,它能够诱导诺拉合成,与此同时,抑制基因表达点头,我们获得了几批商业变质剂。菌剂和未接种泥炭(控制)提取,提取检测其诱导nolA-lacZ表达的能力。显著诱导物活动被发现在所有的各种测试(Loh et al . 2001年)。未经变质处理的泥炭的控件显示很少或没有诱导物的活动。本研究的结论是,商业大豆的复合变质剂包含大量压制点头基因表达,因此,可能减少了接种菌菌株的功效。为了使接种菌细菌植物结瘤,它将不得不启动增长和克服运作的作用。这种延迟可以接种体应变的能力的一个重要因素与本土竞争,土壤根瘤菌普遍存在低人口密度(例如102“5 cfug”)。
大家都知道有一段时间了,虽然点头基因表达需要有节的早期阶段,这些基因的表达被压抑的结节。各种各样的作者推测可能是关闭在足底点头基因表达。NolAl最近,我们取得了令人信服的证据,有可能通过群体感应的作用,需要抑制在足底nodY的表情。我们表达了nodY-GUS融合在野生型b .日本血吸虫和诺拉突变,BjB3。大豆植物接种菌株,结节收获21天后,GUS活性染色。格斯活动才发现结节形成的诺拉突变株。没有nodY表达野生型形成的结节。汤的文化相比,b .日本血吸虫未达到类似结节内的细胞密度。然而,在足底封闭在一个小空间的symbiosome每个细菌和细菌之间symbiosome膜。因此,即使低干扰群体感应信号的合成在足底可以转化为非常高,局部symbiosome浓度。
2。植物应对细菌有节的信号
已知lipo-chitin点头信号由根瘤菌代替几丁质寡聚物,通常四到五iV-acetylglucosamine (GlcNAc)残留,mono-TV-acylated非还一端,携带各种替换的减少和非还终端GlcNAc残留。每个rhizobial物种产生各种点头信号与特定的替换。
我们实验室广泛研究了化学特异性大豆点头信号所需的行动。总之,这些数据表明,在终端2-O-methylfucose残留物的存在,减少GlcNAc至关重要对大豆生物活性只有当LCO Qipo-chitooligosaccharide)是一个五聚物(了科恩et al . 1997年)。如果LCO四聚物,然后fucosylation诱发的分子活性呈现在大豆根头发卷曲或皮质细胞分裂。因此,化学替换和LCO链长是至关重要的。此外,我们的研究结果支持假设点头在大豆至少涉及两个离散信号感知不同化学特异性识别事件。例如,我们发现non-fucosylated点头的混合信号可以克服fucosylated点头信号的要求对赤小豆(豇豆属umbellata)有节(科恩et al . 1999年)。其他工作检查nodulin基因表达以响应信号除了点头。化学,这些研究表明,两个截然不同的识别事件参与点头动作信号。一个信号的步骤有一定的特异性,甚至几丁质寡聚物(如五聚物)会诱发早期nodulins的瞬时表达。然而,持续的表达与需要大豆点头信号。 The existence of two recognition events was supported by finding that expression of the early nodulin ENOD2 could not be induced by the addition of any single LCO or Nod signal. ENOD2 expression was clearly induced only when a mixture of LCO was added. One member of this mixture could be a simple, chitin oligomer, if the other member was a soybean-specific Nod signal.
目前,一个善意的点头的信号受体尚未确定。Etzler et al。(1999)报道,一个独特的植物血凝素(DB46)隔绝豆科植物的根白biflorus。这种植物血凝素发现绑定到信号来自各种根瘤菌的点头。Etzler et al。(1999)表明,外源凝集素具有atp酶活性(即apyrase活动),这是在点头的信号显著增加。因此,凝集素被称为lectin-nucleotide phosphohydrolase (LNP)。d . biflorus现况(例如DB46)表面被发现根头发用荧光抗体标记。抗体直接与现况阻塞有节。最近,我们扩展这些研究通过展示的存在直接同源的d biflorus apyrase (LNP)在其他豆类(如。GS50, GS52大豆(et al . 2000年)和m . Mtapyl-5 truncatula(科恩et al . 2001年)。我们显示,大豆和Mtapyl GS52 Mtapy4从m . truncatula nodulins早期,由rhizobial接种诱导3 h。 Moreover, antibody against GS52 blocked soybean nodulation. M. truncatula mutants defective in very early nodulation events also were defective in Mtapyl and Mtapy4 expression. Therefore, legume apyrases must be considered as candidates for a Nod signal receptor. The Cohn et al. (2001) and Day et al. (2000) studies showed the benefit of analyzing multiple legumes. Isolation of both the soybean and M. truncatula apyrases allowed the identification of a region of microsynteny between the two genomes containing a cluster of apyrase genes.
几丁质寡聚物,可以产生真菌细胞壁endochitinase,可以诱导防御反应或相关细胞反应在许多单子叶植物和双子叶植物。我们之前工作的特异性信号点头动作(科恩et al . 1997年)表明几丁质结合蛋白可能参与点头信号识别(即以与感应)。因此,天et al。(2001)使用125标APEA (aminophenyl乙胺)
害怕共轭V-acetylchitooctaose和iV-acetylchitopentaose配体识别chitin-binding网站从大豆悬浮培养细胞微粒体膜的准备,以及根的准备工作。绑定到这个网站是饱和的显然Kd大约40 nM。竞争实验利用几丁质寡聚物(一般。= 2 - 8)表明,此绑定网站首选高分子量低聚物(一般= 7 - 8)。亲和标签使用1251 -标记yV-acetylchitooctoase配体识别85 kDa chitin-binding质膜蛋白质。85 kDa的结合特异性蛋白质各种几丁质寡聚物与相同的能力低聚物诱导氧化破裂反应,在大豆悬浮培养细胞中碱化。治疗与pentameric大豆悬浮细胞,b .日本血吸虫点头信号也导致中度碱化。所表现出的反应是类似于治疗甲壳素五聚物或四聚物。事实上,点头信号绑定大豆质膜制剂(以竞争与标记配体)也显示了大约几丁质四聚物的亲和力。从这些数据,我们得出的结论是,85 kDa, chitin-binding大豆蛋白可能参与防卫反应由几丁质碎片释放真菌病原体。尽管这种蛋白质似乎绑定到点头信号,它在低亲和力,可能没有参与点头动作信号。 However, Nod signal does act as a significant elicitor of defense-related responses in soybean. Therefore, the possibility arises that Nod signal elicitation of a defense response could affect nodulation.
研究这种可能性,我们最近构建Lotus多糖类化合物植物转基因表达细菌NahG蛋白质。这种酶催化分解儿茶酚的水杨酸(SA)。SA是一种已知的中介的诱导植物防御反应。先前的研究表明,转基因植物nahG无法积累SA和显示减少抵抗病原体的攻击。我们的初步数据表明,l .对虾nahG转基因植物积累在根部的SA显著减少,有节的增加约50%。这些结果符合SA-mediated防御机制的作用在控制豆科根瘤菌的感染。
继续阅读:核内复制是必不可少的在医生前Truncatula共生细胞分化
这篇文章有用吗?
读者的问题
-
达尼埃莱1年前
- 回复
