配体结合与核苷酸和2 oxog Iutarate
答:vinelandii NifL包含一个c端HATPase_c域(图1)组氨酸蛋白激酶和phytochrome-like腺苷三磷酸酶。尽管NifL没有明显表现出组氨酸蛋白激酶或atp酶活性,c端域结合腺苷核苷酸(Soderback et al . 1998年)。Mg ADP的存在增加的稳定性NifL-NifA复杂(钱et al . 1999年),从而抑制转录激活研究所由NifA体外即使NifL蛋白减少的形式(希尔et al . 1996年)。有限的蛋白水解作用实验表明,腺苷核苷酸结合促进NifL c端域的构象变化(钱et al . 2001;Soderback et al . 1998年)。诱变的守恒的残留HATPase_c NifL领域影响核苷酸绑定在这个家庭的其他成员,灭活NifL的信号转导功能,所以无法应对环境研究所抑制NifA活动效应器(佩里等人这本书)。因此核苷酸绑定NifL活动的主要决定因素。
我们曾提出,核苷酸结合NifL可能会提供一个机制来感应ATP / ADP的比例,但这似乎不太可能,因为绑定网站将预期饱和体内。此外,MgADP覆盖的氧化还原反应的能力NifL体外了生理窘境,因为NifL研究所预计要持续抑制NifA活动,独立的氧化还原状态。然而,我们最近发现NifL-NifA系统直接反应一个额外的配体,2-oxoglutarate,对抗核苷酸腺苷的影响在NifL活动,从而减轻由NifL抑制ADP的存在(小et al . 2000年)。自2-oxoglutarate碳的状态,是一个关键的细胞内信号的响应NifL-NifA系统这种代谢物可能反映了一个额外的生理开关失效NifL为了应对碳可用性。的反应NifL研究所和NifA蛋白质2-oxoglutarate在生理范围内,a vinelandii NifL-NifA系统显然是响应2-oxoglutarate体内的细胞内水平时引入大肠杆菌(Reyes-Ramirez et al . 2001年)。
NifL
NifA
时尚氧化还原传感
ADP绑定域a54 RNA监管阿宝| ynierase
交互
DNA结合
图1所示。研究所NifL和NifA域结构。域被分配使用智能(http://SMART.embl-heidelberg.de)研究所的DNA结合域NifA除外。
氨基末端区域a .研究所vinelandii NifA包含的功能大体评定量表域(图1),信号蛋白中的一种无处不在的主题所有王国的生活,其中一些结合环磷鸟苷(Aravind桥,1997)。成员最近的结构测定酿酒酵母YKG9家庭的的功能大体评定量表,表明这个主题的褶皱像的不是域和相似性的绑定的口袋有导致的建议两个主题功能大体评定量表折还可以绑定不同的辅助因子(Ho et al . 2000年)。研究所的GAF领域NifA预计监管功能,当此域名正在移除,研究所产生的截断变体NifA由中央和c端域,截短蛋白不再是容易氧化形成的抑制NifL体外(巴雷特et al . 2001年)。然而,截短蛋白仍被NifL Mg ADP存在时,尽管co-chromatography实验表明在这些条件下形成的复杂研究所是更不稳定,而不是本地NifA(钱et al . 1999年)。GAF域显然有调节作用的核苷三磷酸酶活动研究所的中心域NifA NifL,由于研究所的atp酶活性NifA不再被NifL GAF域时缺席(巴雷特et al . 2001年)。
有发现我们功能大体评定量表域是必要的响应NifL-NifA系统2-oxoglutarate,因为当这个域是缺席,研究所NifL抑制NifA活动甚至在高2-oxoglutarate浓度(图2)。此外,有限的蛋白水解作用实验表明研究所的构象NifA改变在2-oxoglutarate这样之间的链接器区域的功能大体评定量表和中央研究所的域NifA更容易受到胰蛋白酶劈理(图2 b)。由于这种效应是在NifL缺失的情况下,很可能2-oxoglutarate研究所结合NifA,符合该小分子作用的的功能大体评定量表域绑定。研究所提出的构象变化NifA引起2-oxoglutarate可能因此防止NifL研究所抑制NifA腺苷核苷酸的存在,因此有利于nif基因转录时碳和氮的状态都是合适的。
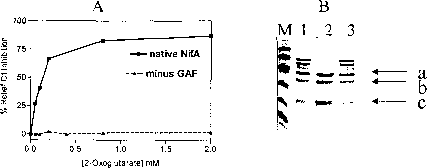
图2。研究所的2-oxoglutarate NifA影响。的的功能大体评定量表(A)作用域m 2-oxoglutarate的响应。抑制由NifL放心米研究所与本地2-oxoglutarate NifA的存在(广场),但m没有域没有观察到任何响应的的功能大体评定量表(三角形)。(B)的影响,对研究所有限消化NifA 2-oxoglutarate胰蛋白酶。巷,分子量标记;研究所巷1,NifA没有增加;研究所巷2 NifA + 2-oxoglutarate(2毫米);研究所巷3 NifA + 3-oxoglutarate(2毫米)。乐队表示为a、b和c代表之前确定胰蛋白酶片段(钱et al . 2001年)。
图2。研究所的2-oxoglutarate NifA影响。的的功能大体评定量表(A)作用域m 2-oxoglutarate的响应。抑制由NifL放心米研究所与本地2-oxoglutarate NifA的存在(广场),但m没有域没有观察到任何响应的的功能大体评定量表(三角形)。(B)的影响,对研究所有限消化NifA 2-oxoglutarate胰蛋白酶。巷,分子量标记;研究所巷1,NifA没有增加;研究所巷2 NifA + 2-oxoglutarate(2毫米);研究所巷3 NifA + 3-oxoglutarate(2毫米)。乐队表示为a、b和c代表之前确定胰蛋白酶片段(钱et al . 2001年)。
3所示。氮传感:Av GlnK与NifL交互
PH-like信号转导蛋白已被卷入的规定在几个diazotrophs固氮。这些三聚物的蛋白质的活动是由可逆uridylylation催化由uridylyltransferase (UTase) (Arcondeguy et al . 2001;Ninfa和阿特金森2000)。PH-like nitrogen-limiting条件下蛋白质uridylylated UTase和de-uridylylated条件下氮过剩。直接作用PH-like蛋白在调节固氮最近才成立。我们已经表明,抑制活动NifL: NifA复杂与非转基因的交互形式的刺激下,大肠杆菌PII和a . vinelandii GlnK的腺苷核苷酸(小et al . 2000年)。PH-like蛋白覆盖了救援的交互抑制观察到高浓度的2-oxoglutarate的存在。我们建议Av GlnK氮状态信号通过与NifL-NifA交互系统条件下的氮过剩的抑制活性NifL松了一口气,高浓度的2-oxoglutarate当Av GlnK uridylylated条件下的氮限制。
GlnK
non-inhibitory
低2-ketoglutarate抑制
高2-ketoglutarate
lr ^抑制
non-inhibitory
图3。监管模式的Av GlnK m NifL-NifA系统应对氮状态。
为了阐明氮传感机制研究所NifL——NifA系统它是必要的,以确定哪些蛋白质组件(s)与PII-like蛋白质和分析这种交互所需的效应器。使用与组氨酸标记蛋白质co-chromatography化验,我们已经观察到Av GlnK与NifL 2-oxoglutarate的存在和ATP(图4)。相比之下,没有观察到互动研究所与NifA(数据没有显示)。
NifL
图4。的Co-chromatography histidine-tagged NifL Av
GlnK。最后的配体浓度:2-oxoglutarate(2毫米);
巷3 NifL + Av GlnK + 2-oxoglutarate
6巷,NifL + Av GlnK E44C + 2-oxoglutarate + ATP
2-oxoglutarate的角色在这种情况下可能反映了要求的绑定Av GlnK配体,因为没有互动的观察2-oxoglutarate NifL独自在配体结合化验。为控制这些实验我们使用一种突变的Av GlnK替换,E44C,表面暴露T-loop与受体相互作用具有重要作用。与野生型Av GlnK相比,蛋白质纯化E44C不刺激NifL体外抑制作用和不与NifL co-chromatography试验(图4)。表面等离子体共振(SPR)实验使用BIAcore仪表也表明NifL与Av GlnK蛋白相互作用。在这些实验histidine-tagged导数NifL缺乏redox-responsive不是域的耦合Ni-NTA芯片和Av GlnK添加2-oxoglutarate和Mg ATP。之间的交互non-uridylylated Av GlnK NifL是Mg和腺苷nucleotide-dependent均与Av GlnK E44C突变,确认co-chromatography实验的结果。自相互作用与NifL截短片段,没有检测到缺少c端核苷酸结合域,它显然需要NifL c端域的。
4所示。突变影响信号转导
我们有孤立的一系列突变在GAF域和研究所的中心域NifA防止NifL抑制。大多数的这些突变阻止抑制NifL固定氮气和氧气,但一些研究所突变NifA蛋白质可以明显区分的抑制形式NifL呈现在不同环境条件下。值得注意的是,研究所突变NifA Y254N显示完整的电阻来抑制体内NifL当文化生长的厌氧条件下氮过剩,但NifL敏感有氧的增长条件。Y254N突变位于中央研究所领域NifA预测一个螺旋,沃克一个主题的一部分AAA + atp酶家族(Neuwald et al . 1999年)。研究所纯化NifA Y254N耐抑制由ADP NifL体外的绑定形式和Av GlnK时也不回应,和2-ketoglutarate被添加到反应。然而,突变蛋白被氧化受到抑制的NifL ADP的存在,尽管NifLox浓度高于观察研究所与野生型NifA蛋白质。体内生化结果因此同意表型的突变和研究所表明,突变NifA蛋白质无法应对氮信号生成通过NifL Av GlnK和腺苷核苷酸之间的相互作用,但对NifL当ADP的氧化形式存在。这些结果表明,复杂的性质之间形成减少NifL研究所和NifA的Av GlnK之间形成不同于氧化NifL研究所和NifA。可能,不同构象的NifL可能生成响应离散信号转导事件。这些事件的离散性质也显著的突变特性的中部地区的NifL灭活的氧化还原反应,但不影响固定氮的响应。这些突变可能不会禁用氧化还原信号本身的看法但干扰通信研究所的这个信号NifA没有明显影响氮信号的转导(佩里等人这本书)。
继续阅读:nif操纵子的组织
这篇文章有用吗?