冻土菌株
众所周知,细菌各系统具有不同的内在抗生素耐药性;而且他们可能cross-resistant几类抗菌药物(Piddock, 2006)。细菌也可能获得耐药性通过特定基因的水平转移其他生物(戴维斯,1994;Tenover, 2006]。研究抗生素耐药性的机制在我们收集的永冻层耐药细菌我们确定抗性基因的定位及其可能与不同的移动元素(质粒、转座子)。
我们首先分析了阻力因素是否可以有质粒本地化。事实上,正是表明大部分的冻土抗生素耐药菌株含有质粒的大小不同(数据没有显示)。抗性基因的质粒分析定位,抗生素耐药菌株窝藏大质粒被选中(见图2)。由碱裂解法提取质粒DNA和分析通过电泳(wt /卷)琼脂糖凝胶0.7% Tris-borate缓冲区,其次是与溴化乙锭染色和可视化紫外线照射下(Sambrook et al ., 1989)。质粒的分子大小进行评估与参考相比质粒R388 (34 kb)(达塔&树篱,1972)和RP4 (60 kb)(雅各&格林特,1975)。
-
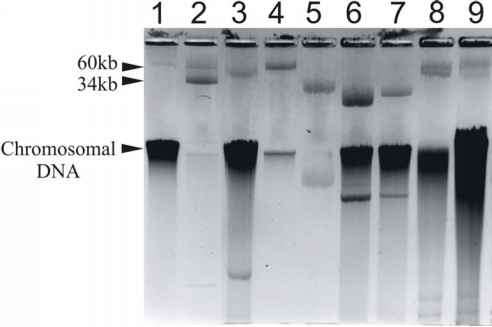
- 图2。质粒的菌株与冻土。水平的琼脂糖凝胶电泳(运行在50 v 18 h): 1 = Tik1, 2 = R388, 3 = ED6-1, 4 = RP4, 5 = MR29-12, 6 = ed94 - 71, 7 = ED23-26 8 = ED23-35, 9 = ED45-25
详细调查我们选择五个假单胞菌菌株,三个不动杆菌菌株和一个应变的Psychrobacter psychrophilus,每个都包含一个大质粒(约25-55 kb)(见图2)。该协会R质粒的抗性基因是决定结合和转换实验与实验室受体菌株。对不动杆菌和Psychrobacter菌株,不动杆菌calcoaceticus应变BD413rif被用作接受者;假单胞菌菌株,采用荧光假单胞菌菌株P22-1-2(表3)。需要注意的是,后者应变对现在四种不同的抗生素都有耐药性(Cb,厘米,Sp, Tp)。为此相应的阻力因素协会在假单胞菌菌株和质粒接合实验无法评估保证。
我们决定,在四个种族,只有水星电阻被转移到相应的接收;三,汞和链霉素抗性因素转移,和额外的两个质粒本地化了链霉素和四环素耐药性,分别和链霉素和抗磺胺噻唑(表3)。
电阻 |
||
冻土菌株 |
耐药模式 |
决定因素与R质粒 |
不动杆菌sp。ED23-35 |
Hg、Sm、Sp |
Hg, Sm |
不动杆菌sp。ED45-25 |
Hg, Sm |
Hg, Sm |
不动杆菌jonsonii M2-7 |
据美联社、Hg、Tp |
Hg |
Psychrobacter psychrophilus MR29-12 |
Tc, Sm Tp |
Sm, Tc |
荧光假ED23-26 |
Hg,公里,Cb,厘米,Sp, Tp |
Hg |
假单胞菌sp。ed94 - 71 |
Hg,公里,Cb,厘米,Sp, Tp |
Hg |
假单胞菌(荧光)EDM6-1 sp |
Hg、Cb、Tp |
Hg |
假单胞菌putida Tik1 |
Hg,公里,Cb,厘米,Sp, Tp |
Hg, Sm |
假单胞菌sp。Tik3 |
Sm,苏,厘米,Sp, Tp |
Sm,苏 |
收件人的特性: |
||
不动杆菌calcoaceticus BD413rif 1 |
(rif-r) |
|
荧光假P22-1-22 |
Cb,厘米,Sp, Tp (str-r rif-r] |
|
阻力因素,也存在于假单胞菌收件人应变,因此无法分析质粒转移,以粗体显示用于交配和不动杆菌菌株Psychrobacter psychrophilus;与假单胞菌菌株交配生下使用;str-r - 30 s-ribosome阻力;rif-r——rpoB rna聚合酶基因的突变
阻力因素,也存在于假单胞菌收件人应变,因此无法分析质粒转移,以粗体显示用于交配和不动杆菌菌株Psychrobacter psychrophilus;与假单胞菌菌株交配生下使用;str-r - 30 s-ribosome阻力;rif-r——rpoB rna聚合酶基因的突变
为了研究R-plasmids的可能作用在电阻不同细菌之间转移我们确定了冻土的宿主范围质粒。收件人在接合实验,实验室菌株p .荧光P22-1-2, a calcoaceticus BD413rif和大肠杆菌k - 12 C600rif。据透露,没有一个质粒被广泛的宿主范围的属性之间的抗性基因质粒能够传播不相关的细菌(表4)。与此同时,一些假单胞菌的质粒转入菌株属于其他假单胞菌的物种。例如,质粒的p . putida Tik1和p . sp。ed94 - 71(荧光)可能是各种实验室菌株的p . putida和p之间传输的荧光(没有显示)。
感兴趣的是,在假单胞菌和不动杆菌质粒研究我们发现几只怀有的汞抗性基因。与此同时,我们成功地检测R质粒窝藏mercury-resistance和病人决定因素。在这一点上应该注意的是,历史上的临床假单胞菌质粒,抵抗HgCl2是第一个标记承认1969年以前。假单胞菌的耐药性质粒研究之后赋予抵抗抗生素不同的家庭除了水银阻力(Kontomichalou, Papachristou & Angelatou, 1976)。因此,我们的研究结果支持先前的结论[休斯&达塔,1983;
戴维斯,1994]抗生素抗性因素可以“拿起”细菌质粒由于引入抗生素在医学和兽医实践。同样的现象可能发生在环境,大幅降低利率。
供体菌株携带抗药性质粒 |
转移R-plasmids与受体菌株的能力 |
||
不动杆菌BD413rif |
假单胞菌P22-1-2 |
E。杆菌C600rif |
|
不动杆菌sp.ED23-35 |
+ |
- - - - - - |
- - - - - - |
不动杆菌sp.ED45-25 |
+ |
- - - - - - |
- - - - - - |
p . psychrophilus MR29-12 |
+ |
- - - - - - |
- - - - - - |
p .荧光ED23-26 |
- - - - - - |
+ |
- - - - - - |
(荧光)ed94 - 71 p . sp |
- - - - - - |
+ |
- - - - - - |
p . putida Tik1 |
- - - - - - |
+ |
- - - - - - |
+抗药性质粒的转移是观察;——转移缺席
+抗药性质粒的转移是观察;——转移缺席
我们进一步分析了抗生素耐药性是否决定因素与质粒可以与转座子本地化。我们成功地隔离两个转座子含有抗生素抗性基因菌株Psychrobacter psychrophilus MR29-12和假单胞菌sp, Tik3分别(见表2和3)。第一个转座子抬抗链霉素和四环素决定因素;第二,链霉素和sulphothiazole。[佩特洛娃et al ., 2008)。我们进一步证明两个转座子都可以把质粒上broad-host-range谱和可能转移到不同的系统的群体包括细菌大肠杆菌和假单胞菌spp。(数据未显示)。抗生素耐药性进一步chracterization R-plasmids和转座子中确定冻土菌株将是未来研究的一个重要目标。
很大一部分的抗生素耐药菌株从我们收集(特别是,各种假单胞菌和不动杆菌菌株),抗生素抗性因素可以转移接合转移质粒DNA和质粒DNA转换。可以表明,在这种情况下,抗性表型可以从染色体编码结果固有电阻(戈麦斯& Neyfakh, 2006)。检查这一假设,我们分析了阻力因素是否与质粒可以通过基因组DNA转移物种之间转换。
耐药不动杆菌菌株MR5-11和VS15包含没有用作供体菌株质粒和模型实验室auxothrophic应变不动杆菌calcoaceticus BD413ivl (Ivl-10)胜任转换(尤尼,1972)是用作受体菌株。基因组DNA的转换,一个简单的转换试验过程描述为不动杆菌spp(尤尼,1972)。制备的原油转化DNA供体菌株进行所述[Sambrook et al ., 1989)。作为一个标记表型跟随抗生素耐药性的变换,我们使用氯霉素抗性(CmR)。评估的效率转换,我们比较的频率变换的氯霉素抗性(CmS ^ CmR)与从营养缺陷型转变为原养型(Ivl - ^ Ivl +)。
实验的结果(表5)表明同源的频率变换的BD413ivl原养型DNA从原养型的分离BD413应变(2.3 x的纯)超过了异种的转换与DNA从冻土不动杆菌分离株(1.6 x10-6和7.0 x10-6、表5)。这个同意发表数据同源和异源的效率转换为不动杆菌物种(尤尼,1972)。我们还观察到转换的氯霉素抗性(Cm-r)从冻土抗株敏感BD413 ivl的压力。Cm-r变换的频率(2.8 - -9.0 x10-7)与Ivl的频率- ^ Ivl +转换。值得注意的是,没有观察到当控制转换耐氯霉素氯霉素敏感菌株被用作DNA来源(表5)。
的DNA来源 |
(每1 p的频率转换。L“DNA) |
|
Ivl + |
Cm-r |
|
VS15 (Ivl + Cm-r) |
1.6 x 1 q 6 |
9。Q x 1 q-7 |
MR5-11 (Ivl + Cm-r) |
7所示。Qx 1 q 6 |
2.8 x1Q-7 |
BD413 (Ivl + Cm-s) |
2.3 x 1 q5 |
< 2。问x1Q-8 |
频率变换确定的数量的比率转化株收件人菌株菌落总数
频率转换决心的转化株的数量比受体菌株菌落总数
考虑到单个染色体基因可以固有电阻不同的抗生素(普尔,2005;Piddock, 2006],我们的耐药模式相比BD413 Cm-r转化株的耐药模式原始抗生素耐药不动杆菌菌株。特别是,我们分析了转化株抗链霉素、壮观霉素、甲氧苄氨嘧啶和非特异性DNA插层剂溴化乙锭。评估抗生素耐药性的水平,我们使用一个双重的连续稀释法(平井一夫et al ., 1986)。收购阻力被定义为至少4倍增加最小抑菌浓度(MIC)。抗生素敏感性的分析模式表明,Cm-r转化株也显示更高水平的抗链霉素,壮观霉素和甲氧苄氨嘧啶。此外,他们的特点是增加抗溴化乙锭(表6)。因此,抗生素耐药性的野生型模式不动杆菌菌株VS15 MR5-8可以被转移到同一属的实验室应变转换他们的染色体DNA,这表明多药耐药性表型可以解释为染色体编码的内在阻力。事实上,这种内在抗前所述了一些种类的不动杆菌(磁铁et al ., 2001;戈麦斯& Neyfakh, 2006)。
表6所示。抗生素耐药性的转移模式之间的永久冻土和实验室不动杆菌的菌株
表6所示。抗生素耐药性的转移模式之间的永久冻土和实验室不动杆菌的菌株
应变 |
麦克风(| g / ml) |
||||
厘米 |
Sm |
Sp |
Tp |
EthBr |
|
永冻层耐药菌株 |
|||||
MR5-11 |
64 - 128 |
> 256 |
256年 |
32 |
128年 |
VS15 |
> 32 |
> 256 |
> 256 |
32 |
64年 |
实验室敏感菌株 |
|||||
BD413ivl |
8 |
4 - 8 |
8-16 |
8 |
至少需要补充16至32 |
转化株 |
|||||
BD413ivl / VS15 |
64年 |
> 128 |
128年 |
32 |
128年 |
BD413ivl / MR5-11 |
64年 |
> 128 |
128年 |
32 |
128年 |
中等收入国家所执行的决心在三个独立的实验中使用Mueller-Hinton介质琼脂稀释法;Cm-chloramphenicol;Sm-streptomycin;Sp-spectinomycin;Tp-trimethoprim;EthBr -溴化乙锭。
中等收入国家所执行的决心在三个独立的实验中使用Mueller-Hinton介质琼脂稀释法;Cm-chloramphenicol;Sm-streptomycin;Sp-spectinomycin;Tp-trimethoprim;EthBr -溴化乙锭。
继续阅读:低温特性在加拿大
这篇文章有用吗?
