离子强度对速率常数
产品,反应的速率是由k [X *], [X *]在哪里活化络合物的浓度处于过渡状态。活化配合物的浓度可以从反应物之间的平衡假设获得和过渡态:
因此
Jx [X = #] aAaB yA[一][B]
= *[一][B],反应速率常数是由
使用Debye-Hiickel限制法律系数y和活动之间的关系离子强度解决方案的书,你会发现日志k =日志k{) +日志丫+日志yu -日志yx * =日志+ 2 bzazu / ' / 2。
与B = 0.51会/ 2摩尔~ l / 2水溶液在25°C,这就变成了日志k =日志Jt0 + 1.02 zazu / ' / 2。
因此一块日志对7 k i / f 2应该给直线的斜率。02 zazu和拦截的日志k {)。常数k()被认为是零的速率常数在溶液离子强度,也就是说,在无限稀释。方程(NN)也预计,同号离子之间的反应应该加快随着离子强度的增加,而电荷相反的离子间的反应应该慢下来增加离子强度。离子间的反应和无电荷的分子(祖茂堂= 0),离子强度不应改变速率常数。这些关系已经确认解决方案充分稀释,这样Debye-Hiickel法律适用(图5.14)。正如所预期的那样,偏差是观察到更高的离子的优势(例如,看到本森的文本,1960年,对于一个更详细的讨论)。
这种离子强度对解速率常数的影响是非常重要的在学习与大气化学反应有关。因此必须注意研究离子强度的影响范围
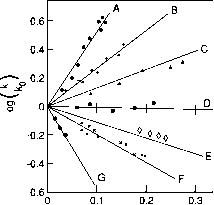
图5.14的变化速率常数与离子强度(/)为反应物有不同费用的解决方案。反应:(A) (Co (NH3) 5 br) 2 + + Hg2 + + h2o - >[有限公司(NH3) 5 (3) F + + + (HgBr);(B) S20 ^ - + I ~ - >(中间体)- > I3 + 2 s042 -(不平衡);(C) [02 nnc00et] - +哦^ N20 + + EtOH;(D)蔗糖+哦——»转化糖(水解反应);(E) H202 + H + + Br ~ - > 3 + l / 2 br2(不平衡);(F) (Co (NH3) 5 br) 2 + +
图5.14的变化速率常数与离子强度(/)为反应物有不同费用的解决方案。反应:(A) (Co (NH3) 5 br) 2 + + Hg2 + + h2o - >[有限公司(NH3) 5 (3) F + + + (HgBr);(B) S20 ^ - + I ~ - >(中间体)- > I3 + 2 s042 -(不平衡);(C) [02 nnc00et] - +哦^ N20 + + EtOH;(D)蔗糖+哦——»转化糖(水解反应);(E) H202 + H + + Br ~ - > 3 + l / 2 br2(不平衡);(F) (Co (NH3) 5 br) 2 + +
Br”
铁(G) + +公司(C204)
+ (Co (C204) 3)。(改编自本森,1960)。
菲接近大气中发现的。气溶胶污染在城市地区可以与离子的优势在高度集中的解决方案的范围8-19 M (Stelson和宋飞,1981);反应在这些解决方案不会遵循前面讨论的“理想”的关系。另一方面,云水和雨水在清洁区域含有溶质浓度较低;例如,从海上地区降水样品的离子组成的角严峻,澳大利亚(Ayers, 1982),离子强度可以计算-10”3 M。
4所示。实验技术用于研究溶液反应
液相的反应动力学研究方法类似于那些在气相,也就是说,使用各种光谱技术遵循一个反应物的损失在存在大量过剩第二反应物。紫外可见光谱法是一种主要工具后稳定的物种和激进分子在溶液中。
章节中讨论7,8,9,有许多自由基物种的化学反应在水相驱动云和雾。这些包括哦,H02 N03,氯等卤素自由基,硫氧化自由基,R02。这些自由基的生成液相用于动力学研究通常使用闪光光解或者脉冲辐解。
闪光光解可以使用宽带光源在200 - 300 nm范围内,脉冲持续时间的微秒的顺序,或与特定波长激光飞秒和纳秒脉冲持续时间。激光的优点在于使用特定波长,同时最小化了光解的反应物或产物出现在其他波段宽带光源,和高可用性的光强度产生较大的激进的浓度。准分子激光器已被证明特别有用:东盟地区论坛在193 nm, KrF在248 nm, XeCl在308 nm, XeF 351海里。
脉冲辐解依赖于高能电离辐射产生的自由基的相互作用在短(¡xs ns)辐射脉冲(看到Pagsberg et al ., 1995)。生成的氢氧自由基可以很容易地通过流程描述不久,和其他物种的二次反应哦。水作为溶剂,轰击电离辐射产生电子(e ~), 3 +,水分子和兴奋,H20 *。电子形成水合电子,e ~或电离额外的水分子。生成氢氧自由基反应的3 + 3 *:
H ?0++ H?0 -> OH + H3Oh
更高的哦,收益率可以获得如果解决方案包含N20:
e - + N20 N2 + O, O + H, 0 -»哦+哦
其他自由基生成,哦可以与其他物种的反应(例如,看到Zellner和赫曼,1995)。例如,
哦+肝细胞癌”——»H20 + COJ (30)
ClOH
对于氯反应,H +在第二步的参与意味着这些反应是氯原子的有效来源只有在pH值小于4。Br -可以转化成溴原子的反应类似于氯,但在这种情况下,原子发生溴代的pH值对f f (Zellner和赫曼,1995)。
光电二极管阵列检测器
光电二极管阵列检测器
-
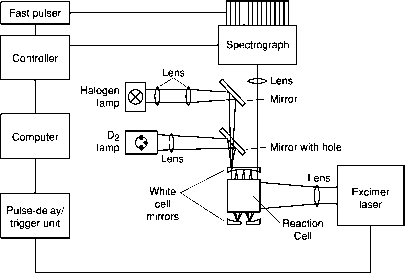
- 图5.15典型装置的示意图用于研究反应动力学的液相(改编自Zellner和赫曼,1995)。
的反应哦硝酸根离子是吸热哦不能用于生成不,在解决方案。通常是由反应等
S202 ~ +高压- 2 s04»(34)
S04“+ no3 S042”+ N03 (-35)
或怪异的硝酸铵溶液的光解在350 nm(如Alfassi et al, f 993):
CeIV (N03) fi”+高压-»N03 + Cem (N03);: ~。(36)
图5.15是一个示意图典型的仪器用于研究水相动力学(Zellner和赫曼,1995)。准分子激光是用于生成自由基物种的利益位于与白细胞光学腔用于获得长总路径长度(例如,60厘米)使用较短的基本路径(见ll.A.lc章)。时间依赖性的自由基反应物的浓度可以使用它吸收光的从卤素或D2灯。在这个特殊的装置,光电二极管阵列检测器使用这一系列wavlengths可以遵循,而不是单一的波长。这允许不同的反应物和产物同时被监控,或者只有一个吸收物种存在,其吸收光谱。
继续阅读:红外光谱谱仪
这篇文章有用吗?
读者的问题
-
中提琴罩3个月前
- 回复
-
Futsum3个月前
- 回复
-
马蒂亚斯3个月前
- 回复
-
琳达9个月前
- 回复
-
ESKO1年前
- 回复
-
eetu lintil1年前
- 回复
