信息Wbl
FigUI 'C 1.1.2:碳酸盐系统:Bjerrum情节(n . Bjerrum命名谁发明了1914年平衡关系的图示);挖= 2.1更易公斤,S = 35, Tc = 25°C。圆和钻石显示pK * = 5.86和pK % = 8.92的碳酸。ph值的值^ < J pk \ v使用8.60和13.22,分别(DOE, 1994)。注意,在海水中,GO2的相对比例,HG03 pH值而不是反之亦然这个情节可能建议(见文本)。
让我们假设一个表面海水样本处于平衡状态与今天的气氛在pC02 = 365 / / atm a pH值为8.1,DIC更易公斤2.1 =“1 salinity3 S = 35和Tr = 25°C。用方程式。(1.1.9)——(1.1.11),我们计算[co2] = 10.4 / imol kg1, (HCO3) = 1818 / /摩尔公斤”1,(公司^ ~)= 272 / /摩尔公斤;总结了常量用于计算DOE(1994),请参阅附录a .换句话说,说的百分比
2的碱度是摩尔公斤为单位。注意单位eq公斤也广泛用于文学。
请注意,任何单位分配给实际的盐度(定义见例如Miiller, 1999)。大约9 = 35对应于每公斤~ 35克盐海水。如果不是说否则,数量将会得到S = 35 T, _ = 25°C,以便与化学文献中的值进行比较。量的计算在其他温度和盐度会留给读者作为练习。
解决物种[co2]: [HCO3]: [C0§~] ~ 0.5%: 86.5%: 13%。因此,在典型的海水条件下,碳酸氢盐是优势种,其次是碳酸盐离子,而只在小浓度溶解二氧化碳的存在。这是如图1.1.2浓度之间的交叉曲线和垂直虚线在pH = 8.1。还表示在图1.1.2的pH值是二氧化碳的浓度等于HCO3的浓度和浓度的HCO3 =公司^ -的浓度。这些pH值对应于pA 'j piq,第一次和第二次的pK值碳酸离解常数,分别在pK值)(参看的盒子。
pK-values。数学上,平衡常数的pK值,“只是K的负面常用对数:
这是在类比的pH值的负面常用对数(H +),化学,pK值有一个有趣的解释。考虑,例如,第一个碳酸的酸性常数:
r——_ [H +] [HCQ3 -] [co2]•1”
让我们假设在一个给定的解决方案中二氧化碳的浓度等于HCO3的浓度。由此可见,[H +]等于KJ:
因此(采取消极的常用对数)溶液的pH值等于pK ^,例如:
这个特性是图形化表示的圆图1.1.2 co2的曲线和HCO3相交。因此,[co2]大于[HCOj] pR值低于pKj(反之亦然)。类似的推理适用于piq -。[HCO3] =[公司§~)在pH = piq。
因为Bjerrum情节(图1.1.2)显示的浓度碳酸盐物种pH值的函数,一个可能会相信pH值控制碳酸盐物种的浓度和相对比例的海洋。然而,反过来也是如此:海水碳酸盐系统的自然缓冲博士为例,如果添加到海水强酸,HC03和齿轮”离子转化为二氧化碳和pH值将保持在8和6之间。只有经过近3更易与H + /
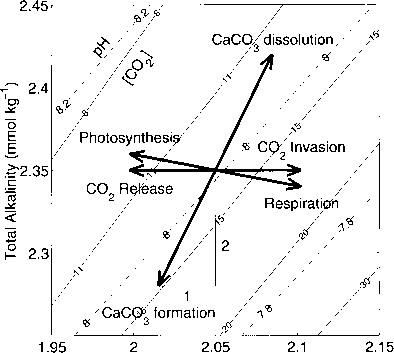
图1.1.3:效果,各种流程的DfC和TA(箭头)。实线和虚线表示害怕不断溶解二氧化碳的水平(在/摩尔公斤”)和pH值,分别作为DIC的函数和助教。CaCO。3形成,例如,降低DIC,助教由两个单位,因此驾驶系统更高的二氧化碳含量和降低大气中的二氧化碳进入海洋的博士入侵增加DIC,而向大气中释放的二氧化碳有相反的效果。TA在这两种情况下保持不变。
图1.1.3:效果,各种流程的DfC和TA(箭头)。实线和虚线表示害怕不断溶解二氧化碳的水平(在/摩尔公斤”)和pH值,分别作为DIC的函数和助教。CaCO。3形成,例如,降低DIC,助教由两个单位,因此驾驶系统更高的二氧化碳含量和降低大气中的二氧化碳进入海洋的博士入侵增加DIC,而向大气中释放的二氧化碳有相反的效果。TA在这两种情况下保持不变。
添加了公斤海水,锁相环会下降明显(见,然而,Sillen (1961、1967);荷兰(1984)进一步阅读)。
许多过程影响碳酸盐系统在海洋中是最好的描述考虑DIC和TA的变化与他们相关联(图1.1.3)。例如,人为二氧化碳的入侵导致增加DIC但不改变TA因为电荷平衡不受影响(见1.5节)。CaC03降低DIC和TA的形成。对于每个摩尔的Ca, C03沉淀,一摩尔碳和一摩尔的双离子带正电的Ca2 +了导致降低DIC和TA的1:2的比例(章节1.6.1)。结果,系统转向更高的二氧化碳水平和较低的pH值(图1.1.3)。光合作用降低DIC和略增加助教,因为除了无机碳营养素(部分1.2.7)编写。由于这些不同的流程,碳酸盐物种和pK调整根据平衡条件的方程组(1.1.5)——(1.1.8),同时必须遵守。总之,记住,是非常有用的pH值和海洋中碳酸盐物种的浓度由DIC和TA在许多情况下的分布。这一事实和各种流程如图1.1.3所示将在后续章节中阐述。
水平衡
碳酸盐系统包括水,其离解产品H +和哦”:K w
3 H ^ + +地方'w离解常数,或离子产品,水。化学平衡常数的定义是:
重要的是要注意,象征“H +”代表水合物复合物与H30 +和H90 ^”而不是免费的氢离子的浓度。自由在任何大量氢离子不存在水的解决方案。然而,方便参考[H +]作为氢离子浓度。这个主题和不同的pH值尺度用于确定水溶液中的氢离子浓度在1.3节详细讨论。
硼acid-borate平衡
碳酸盐系统的定量计算,硼酸,B (OH) 3,硼酸,B (OH) ^ ~,其他次要物种也需要考虑。这是因为这些物种造成的总碱度(TA),结合DIC、碳系统参数经常确定。硼酸,硼酸平衡可以写成:
B (OH) 3 + 3 ^ B (0 H) 4 + H +,可能是硼酸的离解常数。化学平衡常数的定义是:——•
总硼浓度BT是由
Bt = [B (OH) 4 -] + [B (OH) 3]。(1.1.15)
1.1.1效应的温度、盐度和压力
如前所述,温度、盐度和压力影响离解常数的值。可以来源于热力学平衡常数的标准自由能有关的反应。不同系统的温度或压力导致的这种能量,因此改变热力学平衡常数。利用热力学定律,温度和压力影响的表达式平衡常数可以导出。计算的温度和压强下的细节在这里不讨论——我们参考读者如Millero(1979)和Millero (1982)。
通过说,到目前为止,这是可以理解的,平衡常数(/ \ *’s)取决于温度和压力。盐度的影响,然而,不是先天的K *”年代以来理解不应该依赖于合成的如离子解决方案的。盐度的原因依赖的离解常数用于碳酸盐系统的描述(所谓的“化学计量常量”),是他们不是“真正的热力学常数”。热力学常数表达的离子活动而化学常数表达的浓度——1.1.3节中详细讨论这个主题。
图1.1.4 pA 'j的依赖和pk“2温度、盐度和压力。很明显,pK *值的变化导致二氧化碳的相对比例的变化,IICOJ。在一个给定的锁相环和二氧化碳”。对巴勒斯坦权力机构的参考价值”*’s T = 25°C, s = 35岁和P = 1 atm,减少温度和盐度(Tc = 0°C或s = 0)导致的pK *值增加(cf表1.1.1)。因此,当比较如海水35 S =和淡水S = 0pH值和温度二氧化碳-离子的相对比例,对[co2]和[HCO3],将在海水中明显高于淡水。
另一个重要的例子,如碳酸盐系统参数的依赖性。T和P不同化学性质的水质量在表面和深海。让我们考虑一个水包裹冷却从25°C到0°C,然后从海洋表面下沉(> S ' = 35 P = 1 atm)到深海(S - 35, P = 300 atm,即. .深度~ 3公里)。守恒量,只有温度和压力变化,电弧DIC和助教。注意这个例子认为一个假想的“无生命”因为主要等生物学过程
-
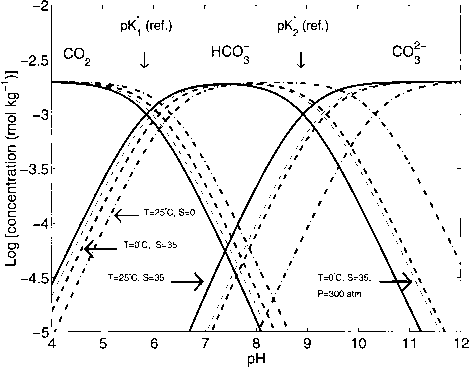
- 图1.1.4:插图的影响温度,压力,和盐度pK *和pKThe参考案例Tc = 25°C, S = 35, P = 1 atm(实线)。值见表1.1.1。注意,DIC = 2更易公斤在所有情况下。
生产和钙化改变DIC和助教在海洋真正的不考虑。从图1.1.4是显而易见的,温度从25°的下降为0°C会导致大量增加在pK *值稍微修改的压力变化。在恒定DIC = 2更易公斤,TA = 2.44更易公斤,沉没的碳酸盐离子浓度水包裹将从316年到286年下降/ miol公斤。在现实中更大的差异(有限公司| _)表面和深海之间的观察,例如~ 300 / imol在表面与~ 100公斤/ /摩尔公斤在深海。这些差异主要是由于生物过程产生垂直梯度在DIC和助教。
总之,减少T, P S,或者导致增加pK ^和碳酸pli ^。同样适用于pK *的离解常数的水,pKand硼酸,pK #, cf,表1.1.1。
表1.1.1:盐度的影响,温度和压力pK *, pK£, pK ^ j,π< b -
表1.1.1:盐度的影响,温度和压力pK *, pK£, pK ^ j,π< b -
Tc (°C) |
年代 |
P (atm) |
piq |
害怕pK * |
pKw |
PKb |
25 |
35 |
1 |
5.86 |
8.92 |
13.22 |
8.60 |
25 |
0 |
1 |
6.35 * |
10.33” |
14.00摄氏度 |
9.24 d |
0 |
35 |
1 |
6.11 |
9.38 |
14.31 |
8.91 |
0 |
35 |
300年 |
•5.96 e |
9.29 e |
14.16摄氏度 |
8.75度 |
aDOE》(1994)——为讨论海水pK *’s中使用这本书,看到1.1.6节。
“Usdowski (1982)。
从Millero ePressure校正(1995)。
aDOE》(1994)——为讨论海水pK *’s中使用这本书,看到1.1.6节。
“Usdowski (1982)。
从Millero ePressure校正(1995)。
什么是占主导地位的碳酸盐物种典型海水pH值为8.2(~海洋表面)和7.8(深海~)?请参阅附录D寻求答案。
用方程式。(1.1.9)——(1.1.11)和pK的值*和pK£在Tc给定表1.1.1,计算二氧化碳的浓度,HCO ^,和挖= 2更易公斤。
1.1.2离子强度和活度系数
淡水和海水之间的主要区别是总浓度和离子的相对比例溶解在解决方案。在集中的解决方案中,离子相互作用从而不会表现出他们的全部潜力与其他化合物发生化学反应。在进入这个问题的细节之前,让我们简要地总结当前的内容部分与下面的例子。
想象一个体积的水从河流向大海的春天。随着方案的变化从淡水到海水,即在溶液中离子的数量增加,离子活度降低由于(a)远程静电相互作用和(b)离子配对和复杂的形成。因为不同的化学物种的活动带有不同电荷的影响方式不同,他们的活动变化的比率。考虑的例子pK %(参见图1.1.4),公司的活动^ -
减少更强烈,例如HCO3的活动。因此,pA的海水小碳酸二(2)大于其相应的价值在淡水。这就解释了为什么海水有一个更高的齿轮-浓度(相对于二氧化碳的浓度和HCO3)比淡水pH值。
离子强度
用于描述水的量是含有不同浓度的离子的解决方案离子强度。/介质的离子强度,定义为:
继续阅读:IxciZi雷竞技csgo1116
这篇文章有用吗?
